Amikor utánanéztem az aktuális adatoknak, megdöbbentem. Fogalmam sem volt, hogy Alzheimer már az ötödik vezető halálok a világban, s hogy Magyarországon egy nagyvárosnyi ember élete megy tönkre emiatt: jelenleg kétszázezer beteget tartanak nyilván.
Ráadásul, ha a probléma valós mértékéről akarunk képet kapni, ezt a számot felszorozhatjuk kettővel vagy hárommal. Egyrészt a diagnosztika adottságai miatt mindig alatta van a hivatalos betegszám a ténylegesnek. Másrészt egy ilyen beteg mellett minimum egy, de lehetőség szerint két személynek jelen kell lenni segítőként. Amíg a betegek tudnak mozogni, folyamatosan szemmel kell őket tartani, hogy
magukra ne rántsanak valami forró dolgot, el ne essenek, be ne zárkózzanak valahová, ki ne szökjenek, el ne tévedjenek.
Ráadásul van egy hullámzás, tehát nem egyenletesen robogó gyorsvonatról van szó. A beteg tudata néha feltisztul, ilyenkor visszaköveteli az önállóságát. Évekig tartó gondozási folyamatról beszélünk.
És hogyan állunk az intézményi gondozással?
Ahogy más egészségügyi területeken, Magyarországon e téren sem megoldott a szakellátás. Pedig mindig van egy pont, ahol otthonba kellene adni a beteget, különben ez a visszafordíthatatlan leépülés a család rovására megy.
A beteg előrehaladott állapotban nem mozog, mert nincs rá késztetése; csak ül, aztán már csak fekszik. Viszont az otthonok többsége sajnos olyan, hogy az ember nem szívesen hagyja ott azt, akit szeret.
A több százezer betegre jut néhány megfelelő szakintézmény, de csak annak, aki meg tudja fizetni.

Hol az a pont, amikor valakinek a viselkedéséből arra lehet következtetni, hogy a betegség megkezdődött?
A memóriazavarok jelenthetik az első gyanút.
Van, hogy nem jut eszembe az ismerőseim neve. Nem beszélve arról, hogy hová tettem a lakáskulcsomat…
Ezzel én is így vagyok olykor, de amíg észrevesszük, nincs gond. Az első igazán gyanús jel, amikor a környezet már jelzi, de az illető még nem veszi észre a kihagyásokat. Tájékozódási problémák lépnek fel, amiken a térkép sem segít. Egy normál analóg órán nem ismeri fel a beteg, hogy mennyi az idő. Az absztrakt információkkal nem tud mit kezdeni. Ez halad előre a teljes leépülésig.
Mibe halnak bele végül az alzheimeres betegek?
Szinte mindig valami fizikai szövődmény lép fel. Például az előrehaladott állapotú beteg nem tud nyelni, mert elfelejti, hogy ott az étel a szájában, és előfordul, hogy félrenyel, és kap egy tüdőgyulladást.
Száz éve, mikor felfedezték, az Alzheimer még a ritka betegségek közé számított. Mitől növekszik ilyen dinamikusan a betegek száma?
Attól, hogy az átlagéletkor is növekszik, és az Alzheimer 90 százalékban az időskor betegsége. Azon kívül a civilizációs ártalmak, az életmód is nagyban hozzájárul a kialakulásához. A keringés és az anyagcsere állapota szoros összefüggésben van a demenciával. Szóval mindenképp érdemes aktív életmódot folytatni, az agyunkat minél tovább használni, rendszeresen terhelni fizikailag a szervezetet, hogy az agyi keringés is rendben legyen. Nagyon fontos lenne a megfelelő minőségű és mennyiségű alvás, vagyis egy csomó olyan dolog, aminek a civilizációnk pont ellene dolgozik.
Helyes életmóddal az Alzheimer megelőzhető?
Nagyon szívesen mondanám, hogy igen, de sajnos legfeljebb a valószínűségét csökkenthetjük. Sok mindent lehet találni a klinikai előzményekben, igen gyakran emelkedett koleszterinszintet, infarktust, agyvérzést, keringési zavarokat. De ezek még összeadódva sem jelölhetők meg okként. És itt a fő probléma: a mai napig sem tudjuk pontosan az okot, nem tudunk rámutatni arra, hogy ha ez vagy az elromlik a szervezetben, megjelenik az Alzheimer. Sokféle hajlamosító gént azonosítottunk, de az alzheimeresek mindössze tíz százalékánál mutatható ki valamilyen jellegzetes genetikai elváltozás.
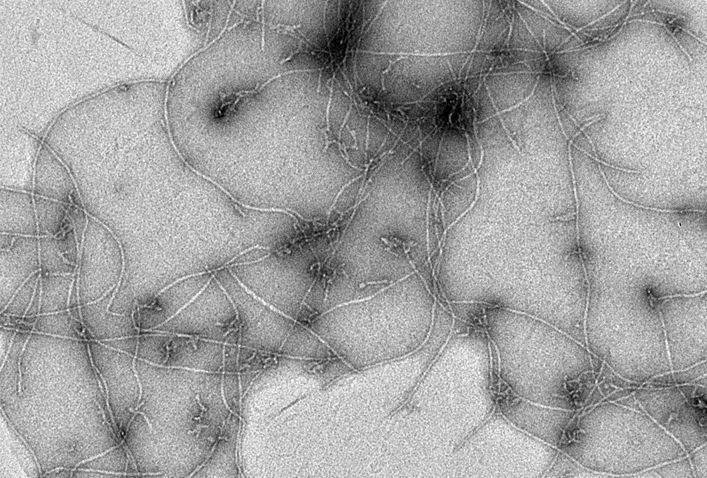
Mi az oka annak, hogy nem sikerült máig sem kifejleszteni egy gyógyszert, ami rendbe hozza a betegek memóriáját?
Ehhez pontosabban kéne tudnunk, hogyan működik az agyunkban a memória. Persze sok információnk van már a biokémiai folyamatokról, amelyek elvezetnek az emlékek tárolásához, de arra kéne rájönnünk, hogy mindez az alzheimeres agyban hogyan és – főként – miért sérül. Mindenesetre, ha nem a tünetek, hanem az agyi idegsejtek szintjén lejátszódó folyamatok felől nézzük, van két nagyon fontos fehérje, aminek a felszaporodása jól jellemzi a betegséget. Béta-amiloidnak nevezzük azt, ami a sejten kívül, és tau-fehérjének, ami a sejten belül jelenik meg, és fehérje-aggregátumokba rendeződik. Egyszerűbben szólva, ezekből a fehérjékből plakkok képződnek, amelyek gátolják a neuronok, vagyis az idegsejtek egymás közti kommunikációját.
Nem lehet valahogy eltávolítani ezeket a plakkokat?
Az Alzheimer-kutatás alapkoncepciója nagyon sokáig az volt, hogy miként lehetne ezeket a plakkokat kitakarítani az idegsejtek közül. Aztán kiderült, hogy van olyan alzheimeres is, akinek nincs ilyen plakk az agyában, mégis demenciatüneteket mutat. Nemrég arra is rájöttünk, hogy biztosan nem csak a plakkok felszaporodása okozza az agyi idegsejtek pusztulását. Sőt: valószínűleg azért képződnek, mert ezzel védekezik a szervezet.
A legújabb álláspont szerint ezek a sejt közti plakkok úgy működnek, mint megannyi kuka. Ide üríti az idegsejt azt, ami a számára toxikus, és ez a plakk bezáródik, elücsörög a sejteken kívül. Ma már azt gondoljuk, hogy elsősorban nem ide kell céloznunk, hanem a sejten belülre.
Ott ugyanis van egy korábbi fázis, amikor nagyon kis fehérje-tömörülések alakulnak ki; ezt úgy képzelje el, hogy hat-nyolc-tíz fehérjeszálacska egyszer csak összeáll, de ez még messze van attól, hogy nagy fehérje-aggregátum, vagyis plakk legyen belőle. Csakhogy ezek a kis kezdemények is elegendők ahhoz, hogy az idegsejt biokémiáját összezavarják.
Időben kéne észrevenni és felszámolni ezeket, mielőtt beindul a plakk-képződés.
Az egyik nehézség az, hogy ez a dolog rettentően pici, jellemzően néhány nanométer átmérőjű. A nanométer tíz a mínusz kilencediken méter, tehát sok-sok nagyságrenddel vagyunk mondjuk egy hajszál vastagsága alatt. Esélytelen, hogy normál mikroszkóppal meg lehessen figyelni, egyfajta vizsgálati lehetőséget az elektronmikroszkóp kínálhat.
Valahogy láthatóvá kéne tenni a folyamatot, de nem tudok sejtszintű vizsgálatokat végezve bekandikálni egy élő agyba; történhetne valamilyen biopsziás mintavétel, mint a daganatok esetén, de az ilyen invazív eljárásokat kerülni szokás. Szóval nincs technológia arra, hogy ezeket a pici toxikus aggregátumokat megfigyelhessük.
Pedig ha ezeket a sejten belül el tudnánk csípni, a mennyiségüket valahogy szabályozni vagy a keletkezésüket megakadályozni, az hatalmas dolog volna.

Gyakran hallani, hogy a gyógyítás új útja az immunoterápia: az immunrendszert megtanítják, hogy azonosítsa be, majd hatástalanítsa a betegséget okozó mikroorganizmusokat. Ezt daganatos betegségeknél már alkalmazzák. Nem lehet az Alzheimer tüneteit okozó fehérjék ellen is bevetni?
Ez olyan fontos iránya az Alzheimer-gyógyszer kutatásának, hogy jelenleg 4 olyan immunoterápiás készítmény van, ahol a tesztelés a harmadik fázisba jutott; a harmadik fázis pedig azt jelenti, hogy már a betegségben szenvedő embereken próbálják ki. A betegek egyik része placebót kap, a másik része a hatóanyagot, és megnézik, melyik csoportban van tényleges memóriajavulás, illetve a PET CT-n látszik-e a plakkok csökkenése. A tesztelt gyógyszerek közül a bajkeverő fehérjére, vagyis az amiloidra célzottak közül a döntő többség antitest, a többi valamilyen plakkosodásgátló.
Az antitest lenne az immunrendszer fegyvere a betegség ellen, ezt a Covid-19 vírussal összefüggésben gyakran hallani.
Na igen, de az Alzheimer-kór esetében az antitest-terápiával még vannak komoly problémák. Például, hogy az antitest nem negyvenkét aminosavból áll, mint a célpontja, hanem a többszöröséből. Az antitest viszonylag nagy méretű fehérje, ami a vérárammal közlekedik a szervezetben.
Csakhogy az agyban van egy olyan struktúra, amit véragygátnak nevezünk. Ez védekező rendszer, ami egyfajta speciális sejtréteg: tulajdonképpen szűrő, ami nem enged át mindent. Ha a vérárammal minden bejuthatna az agyamba, ami a szervezetemben kering, akkor pár nap alatt meghalnék.
Mármost a kívülről bejuttatni kívánt antitestek közül rendkívül kevés tud átjutni a véragygáton. De ez csak a probléma egyik része, és bizonyos esetekben csökken a jelentősége, ugyanis az alzheimeres betegeknek sérül a véragygátjuk, vagyis a szűrő lyukas lesz, ami által sikeresebb lehet az antitest bejuttatása. De ha valahogy az antitestet becsempésszük, és bent vagyunk az agyban, sőt, ott vagyunk már a plakknál, akkor sem biztos, hogy azt kéne célozni. Inkább be kéne jutni a sejtbe. De mivel az antitest hatalmas szerkezet, önmagában nem képes erre.
Szóval matt.
Ezzel a stratégiával igen, de a játszmának még messze nincs vége.
És ezért haltak meg olyan sokan 2002-ben? Volt egy kísérlet, aminek tragikus következményei lettek.
Akkor az aktív immunizálást próbálták meg, azóta jellemzően a passzív immunizáció irányába fordultak a kutatások. Az a különbség a kettő közt, hogy a passzív módozatnál elkészítik laboratóriumban az antitestet, majd beadják; aktív immunizálásnál pedig ráveszik a szervezetet, hogy termeljen antitesteket.
Ebből lett a baj: túlstimulálták az agyat, ami kóros folyamatokat indított el, ezért a betegek egy része a kísérlet során agyvelőgyulladást kapott, néhányan sajnálatosan meg is haltak.
Az eredmények és az etikai szempontok figyelembe vétele végül a projekt leállításához vezetett. Azóta a favorizált út inkább a passzív immunizálás, tehát antitesteket készítenek.
De minek, ha az nem juttatható be az idegsejt belsejébe?
A bejuttatás problémáján kutatócsoportok dolgoznak világszerte.
2019 őszén újra felröppent, hogy megtalálták az Alzheimer ellenszerét.
Igen, az egyik antitestet fejlesztő cégcsoport azt mondta: újraértékelték az eredményeket, és úgy látják, mégiscsak volt olyan kezelés, ami pozitív mérleggel zárult. Most folyik egy kiterjesztett harmadik fázisú teszt a biztonságosság és a tolerálhatóság tekintetében, viszonylag nagy, 10 mg/kg dózissal. De azért tudni kell, hogy 2002 óta minden eddigi kísérleti gyógyszer hatástalannak bizonyult a harmadik fázisban, és a rájuk fordított anyagi források is mind veszendőbe mentek.
A sorozatos kudarcok nyilván a befektetők kockázatvállalási kedvét is alaposan lecsökkentették, emiatt a gyógyszergyárak ilyen irányú projektjeiket is átirányozták, a targetek csoportját kiszélesítették. Tehát, ha azzal állok elő, hogy kizárólag Alzheimer-gyógyszert fejlesztek, eleve bizalmatlanul fogadnak.
Emellett nyilván próbálnak a meglévő eredményekből a legtöbbet értékesíteni. Tavaly is ez történt. A „végre van valami a kezünkben” érzés nagyon vonzó opció, sokaknak reményt adhat.
Mintha szkeptikus lenne a kísérlet sikerével kapcsolatban.
Nézze, csakugyan van egy molekula, ami működhet. Ez a jó hír, ez vitán felül áll. De tegyünk egy óvatos becslést, mennyi kellene egy ember kezeléséhez ebből. Az eddigi eredmények ismeretében igen magas dózist, ebből a bonyolult fehérjéből 10 milligrammot kellene egy betegnek beadni testsúlykilogrammonként, minden alkalommal, amíg tart a terápia. Átlagban hetvenkilós egy ember. Hétszáz milligrammról beszélünk, ez már C-vitaminból sem kevés, de az egy olcsó, nagy tömegben előállítható anyag. Viszont ha egy mesterségesen termelt fehérjéből kell bejuttatni ennyit egy beteg szervezetbe, az kis túlzással horrorisztikus költségvonzattal jár. A magyar egészségügyre ez hatalmas terhet róna, a betegek egyre növekvő számát is figyelembe véve.
De ha nem nézzük az árat és a kockázatokat, akkor nem lehetséges, hogy mégiscsak előrelépést jelent ez a teszt a terápia felé?
Képalkotó eljárással vizsgálva csökkent a plakkok mérete, és állítólag látszik a tényleges memóriajavulás is. De még mindig itt tartunk, hogy a külső plakkokat vizsgálgatjuk, és az előbb beszéltük meg, hogy a mai tudásunk szerint ez nem igazán célravezető. Feltételezhetően van egy külső-belső egyensúly, tehát ha a külső nagyokat el tudjuk takarítani, akkor elképzelhető, hogy az a belső kicsiket is fékezi. De ez még mindig nem az, ami tényleges és átütő eredménnyel járhatna, hiszen nem azzal foglalkoznak, hogy a sejten belül ne alakuljon ki toxikus fehérjeképződés. A következményeinél akarják megragadni a problémát, és nem a keletkezésénél, ez a gond.

Az ön kutatásának viszont a sejten belül ható gyógyszer volna a lényege.
Találtunk is olyan molekulát, ami ha bejut a sejtbe, a kis belül termelődő aggregátumokhoz kapcsolódik. Van egy mesterséges körülmények közt alkalmazható tesztünk is, ami kísérleti állatokban már alkalmasnak bizonyult a belső aggregátumoknak akár a vérből történő kimutatására. Nagyon sok más csapat is dolgozott ezen a témán, de sajnos, ezek a gyógyszerek is sorra elbuktak a széles körű tesztelések során.
Viszont tavaly a kutatási eredményeiért L’Oréal-díjat kapott.
A L’Oreal-díjat eddigi, nőként a tudományban elért eredményeimért kaptam, nem feltétlenül a legutóbbi témánkkal kapcsolatosan, hiszen ezzel a díjjal egy kutatónő eddigi tudományos munkáját egészében méltatják. Mindemellett a kutatás mindig közös tevékenység, tehát a csoportom megfeszített munkájának is az elismerése ez. De amit most csinálunk, valóban új irány. Az a gondolatunk, hogy engedjük el az eddigi próbálkozásokat az amiloid eltakarítására, próbáljunk más biokémiai folyamatokat azonosítani a betegségben, és ezekre terápiát találni. Annál inkább, mert feltételezhető, hogy ezek nem csak az Alzheimer-kórban, hanem más neurodegeneratív betegségek esetében is hasznosak lehetnek.
Egyszerűen jobban tolerálják a gyógyszergyárak, ha azt mondom, hogy az én gyógyszerem többféle betegség során fellépő memóriazavar gyógyítására alkalmas lehet, sőt, akár a depresszió kezelésére is.
A kiindulási alapunk egy sejten belüli jelenség: az úgynevezett endoplazmás retikulum stressz. Ugyanis, amikor megindul az Alzheimerhez vezető toxikus fehérjeképződés, akkor az idegsejt megérzi, hogy nem tud annyi energiát termelni, mint kéne, nem tud megfelelő molekulákat előállítani, tehát baj van. És innentől a játék kétesélyes. A sejt kiverekszi magát a helyzetből a saját biokémiai folyamataival, vagy ha ez nem sikerül, elindulnak azok a folyamatok, amelyek során megsemmisíti önmagát.
Tehát vagy megoldja, vagy öngyilkos lesz?
Pontosan. Viszont ha megtámogatom ebben a helyzetben egy megfelelő anyaggal, hogy ne érezze magát annyira vacakul, vagyis enyhüljön a stresszállapot, akkor ez terápia lehet, hiszen a sejt életben marad. És ugye az Alzheimerre jellemző egyik legdurvább folyamat éppen a brutális sejtpusztulás. Ezért olyan szomorú látvány egy alzheimeres agy, amin látszik a sorvadás, a struktúra felbomlása. Az ember próbálja finoman elmagyarázni, de sajnos, azt kell mondani, hogy ami ennyire szétmegy, azt csak a csodával határos módon lehetne újra felépíteni.

Akkor csak mítosz, hogy az agysejtek regenerálódnak?
Nem mítosz, ezt a folyamatot neurogenezisnek hívjuk, és ma már tudjuk, hogy nemcsak magzati és újszülötti korban keletkeznek idegsejtek, hanem felnőttkorban is. Ennek vannak sajátos biokémiai folyamatai, de sajnos az Alzheimer-kórban ezek is sérülnek, tehát a romlás visszafordíthatatlan. Persze azért vizsgáljuk, mennyire lehetne felturbózni a javító mechanizmusokat, amelyek során a sérült területeken esetleg új neuronok tudnak munkába állni, de e tekintetben még az alapkutatás szintjén járunk.
Az idősödés pont arról szól, hogy a javító mechanizmusaink egyre kevésbé működnek, tehát az alzheimeres betegeknél ez csakugyan nem tűnik nagyon kecsegtetőnek.
Van, aki azt mondja, hogy épp azért alakul ki az Alzheimer 65 év felett, mert ezek a javító mechanizmusok túlzott mértékben károsodnak. Ez logikusnak tűnik, viszont akkor azzal a talánnyal találjuk magunkat szembe, hogy miért nem lesz bizonyos kor után mindenki alzheimeres. Mindenesetre ha bármit megjavítunk, ami az agyban egy ilyen betegségnél sejtszinten elromlik, azzal vélhetően a beteg állapotát is javítjuk. És ez a legfontosabb.
Ha látható stresszreakciót vált ki a későbbi plakk kialakulásához vezető első fehérjeképződés, akkor mégiscsak megvan a kulcs, nem? A folyamatot a kezdetén el lehet csípni.
Az a gond ezzel, hogy a sejtjeink stresszreakciói a különböző stresszekre nagyon hasonlók, tehát az alzheimeres tüneteket okozó fehérje-aggregáció kezdete sem vált ki specifikus reakciót. A stresszt látom, de nem tudom a pontos okát. Szóval a sejten belüli stressz kutatása inkább egy másik szempontból izgalmas. Ha például melegíteni kezdünk egy sejtet kívülről, hősokkot kap. A szervezetünkben van egy csomó úgynevezett hősokk-fehérje, ezeket arra tartjuk, hogy a hő által okozott problémákat megoldják. Kiderült, hogy ezek a fehérjék nemcsak a hősokk okozta traumát kezelik, hanem egy sor egyéb stresszt, például az Alzheimer-kórhoz vezető fehérje-aggregátum megjelenését is. Most abba az irányba mozdulunk, hogy a hősokk-fehérjerendszer elemeit kapcsoljuk betegségekhez.
Valaminek muszáj történnie, mert a trendeket nézve a probléma egyre súlyosabbá válik. Néhány évtized, és nem lesz család, amelynek ne kéne ezzel a szörnyűséggel megküzdenie.
Megtesszük, ami tőlünk telik. A gyógyszergyárak azt szeretik, ha úgynevezett preklinikai dossziét kapnak, ami azt jelenti, hogy az első fázisú vizsgálatot elvégeztük; ez állatkísérletek sora, melyekben az anyag hatásossága bizonyítást nyer. Ezt kiegészíti az állatokon végzett toxicitásvizsgálat. Mármost egy jó ötlettől ilyen preklinikai dossziéig eljutni szerencsés esetben nagyjából öt év. És akkor ott állok a gyógyszergyár kapujában, rendeznek egy meghallgatást, bemutatom, hogy mim van, ők pedig eldöntik, hogy milyen további vizsgálatokat végeznek. Ha akarnak ezek alapján gyógyszert fejleszteni, jön a többi fázis, ami további súlyos éveket jelent.
Tíz–tizenöt évnél hamarabb a nulláról nem lehet valamit kifejleszteni. De őszintén szólva nem is hiszem, hogy valaha is színre lép egy kutató a szupergyógyszerrel. Nincs Szent Grál, ami mindenre megoldást jelent.
Inkább azt tartom valószínűnek, ami az onkoterápiában történik. Ezek ellen a betegségek ellen úgy lehet hatékonyan küzdeni, ha minél több fronton harcolunk, ezért valamilyen kombinációs terápia lesz a megoldás, ami több ponton próbálja helyrerakni a sérült idegsejteket, és ahol csak lehet, megelőzi a további sérülést.

Összefogás kell a kutatók közt?
Hasznos, ha többen többfelől nézünk egy problémát: az egyik észrevesz valamit, amit a másik nem. Az összefogás tehát fontos lenne, de hogy mit tartunk meg magunknak, és mennyire kooperálunk másokkal, ez mindig egzisztenciális döntés is a kutatócsoportoknak. Hosszú évek kooperációja és konferenciák látogatása után az emberben az is lecsapódik, hogy kelet-európaiként nem könnyű boldogulni. Én, ha akarnám, sem tudnám megtartani az eredményeimet, és egyszer csak előállni valamivel, ami megmenti a világot a demenciától, hiszen nem tudom a teljes kutatáshoz szükséges anyagi hátteret biztosítani.
De hát a tudományos kutatás nem is versenysport. Nem az a lényeg, hogy magyar siker legyen.
Nem, de persze mind örülnénk, ha mégis így alakulna. Tudom, ez kicsit olyan kérdés, hogy orosz vagy amerikai vagy kínai, esetleg magyar vakcina legyen-e a koronavírus ellen, miközben a közvéleményt elsősorban az érdekli, hogy legyen már egy biztonságos és mindenki számára elérhető védőoltás, és marginális, honnan származik.
Amíg a betegség nem gyógyítható, vannak-e hatékony szerek, amik legalább a tüneteket enyhítik?
Az alzheimeres beteg nagyon összetett tünetegyüttest tud egy idő után produkálni. Számos memóriajavítót próbálnak ki pillanatnyilag is. A sejtek kommunikációját elősegítő gyógyszerek közül néhányat már régóta használunk. Van antiepileptikum, amit azok az alzheimeresek kaphatnak, akiknek epilepsziás rohamaik vannak. Létezik szer, amely a szerotoninszintet szabályozza; ezt depresszióban használják, ami sajnos az Alzheimer-betegekre is jellemző. És tesztelnek jelenleg gyulladáscsökkentőket, hiszen az idegsejtek gyulladásos állapotával is jár ez a betegség. Ezek így együtt képesek a beteg életminőségét javítani, a romlást jelentősen lassítani. Talán a közeljövőben meg lehet már állítani a folyamatot egy olyan szinten, ahol az életvitel önállóan fenntartható. De a tényleges gyógyításra sajnos még sokat kell várni.
Kiemelt kép: Ivándi-Szabó Balázs /24.hu








